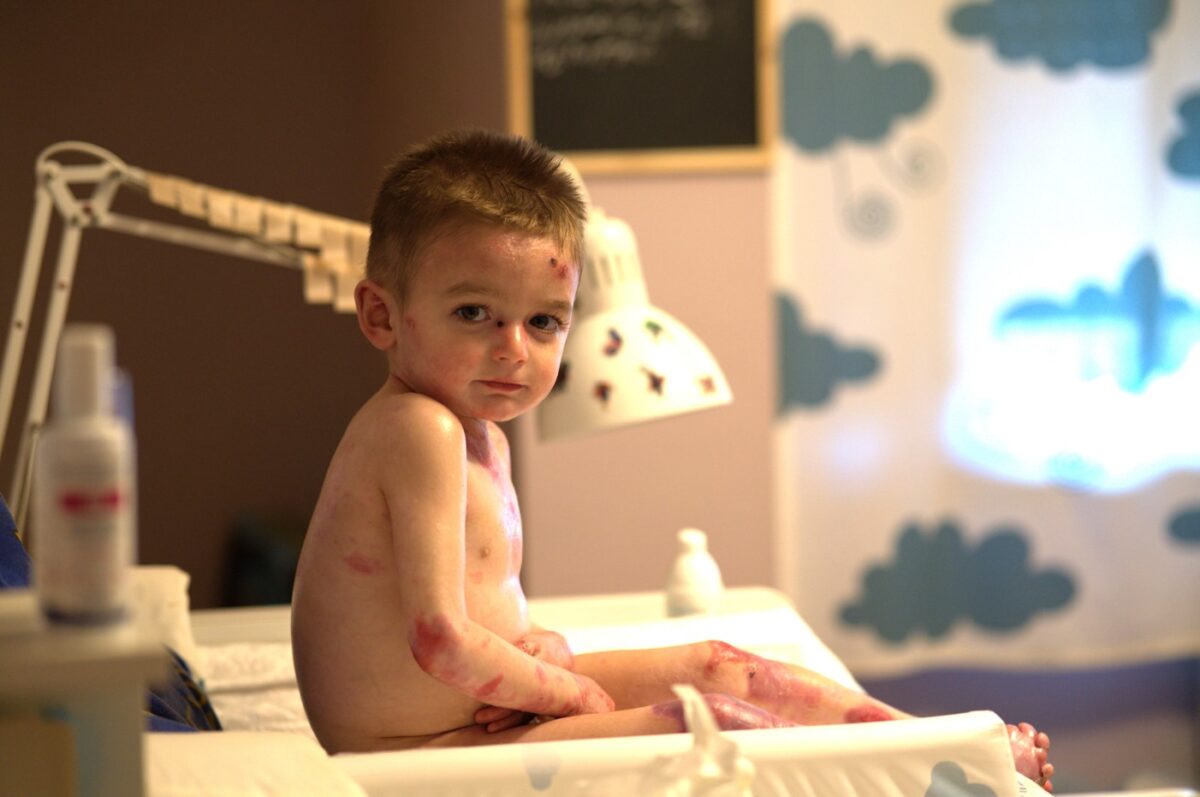
Leo tiene muy claro su sueño. Le encantaría ser periodista para poder anunciar en un informativo que se ha encontrado la cura para la Piel de Mariposa. “Eso me alegraría muchísimo”. Afirma.
Leo es un niño sevillano de 11 años que padece Epidermólisis bullosa, más conocida como Piel de Mariposa: una enfermedad genética, degenerativa e incurable a día de hoy, que provoca una extrema fragilidad de la Piel. El más mínimo roce le provoca heridas y ampollas, por lo que debe someterse a curas diarias de hasta 3 horas. Acciones tan cotidianas como comer, ducharse o vestirse, se convierten en un auténtico reto.

Toda su familia vive con la esperanza de encontrar la cura. Por ello, han recibido con tanta alegría la noticia de que la Agencia Europea del Medicamento haya aprobado el VYJUVEK. La primera terapia génica de aplicación tópica indicada para la Epidermólisis distrófica. El mismo subtipo que tiene Leo.
“Aunque no se trate de una cura, este medicamento sí que puede mejorar notablemente la calidad de vida de las personas con EB distrófica”, afirma Núria Tarrats, coordinadora de investigación de la ONG DEBRA Piel de Mariposa.

En Estados Unidos ya se ha empezado a utilizar, y se ha demostrado que es capaz de cicatrizar heridas que llevaban abiertas varios años, y que consigue “pegar” correctamente la dermis y la epidermis. De esta manera, las heridas tratadas con el VYJUVEK se cerrarían antes, y esa zona sería, durante unos meses, resistente a ampollas y heridas típicas de la enfermedad.
El Colágeno: el pegamento de la piel
Este tratamiento se encarga de transportar, mediante un vector viral del herpes simple (virus VHS-1 inactivado), dos copias sanas del gen del colágeno 7 (COL7A1). Dicho vector suministra la información necesaria para que la propia célula produzca la proteína del Colágeno 7 sana, para que esta funcione correctamente. Esta terapia tendrá que ser administrada por profesionales de la salud en un entorno sanitario, aunque se espera que, en un futuro, se pueda aplicar en casa.
Plazos de aprobación y entrada en el Sistema Nacional de Salud
El acceso de las familias no será inminente. Tras la aprobación de la EMA y la Comisión Europea, según los cálculos extraídos de los informes de la AELMHU, se estima que habrá que esperar otros dos años hasta llegar a un acuerdo con el Ministerio para su entrada en el Sistema Nacional de Salud.
Desde DEBRA Piel de Mariposa, han manifestado que harán “todo lo que está en su mano” para facilitar su acceso y presionar a la Administración Pública para que “la burocracia no abra más heridas”.
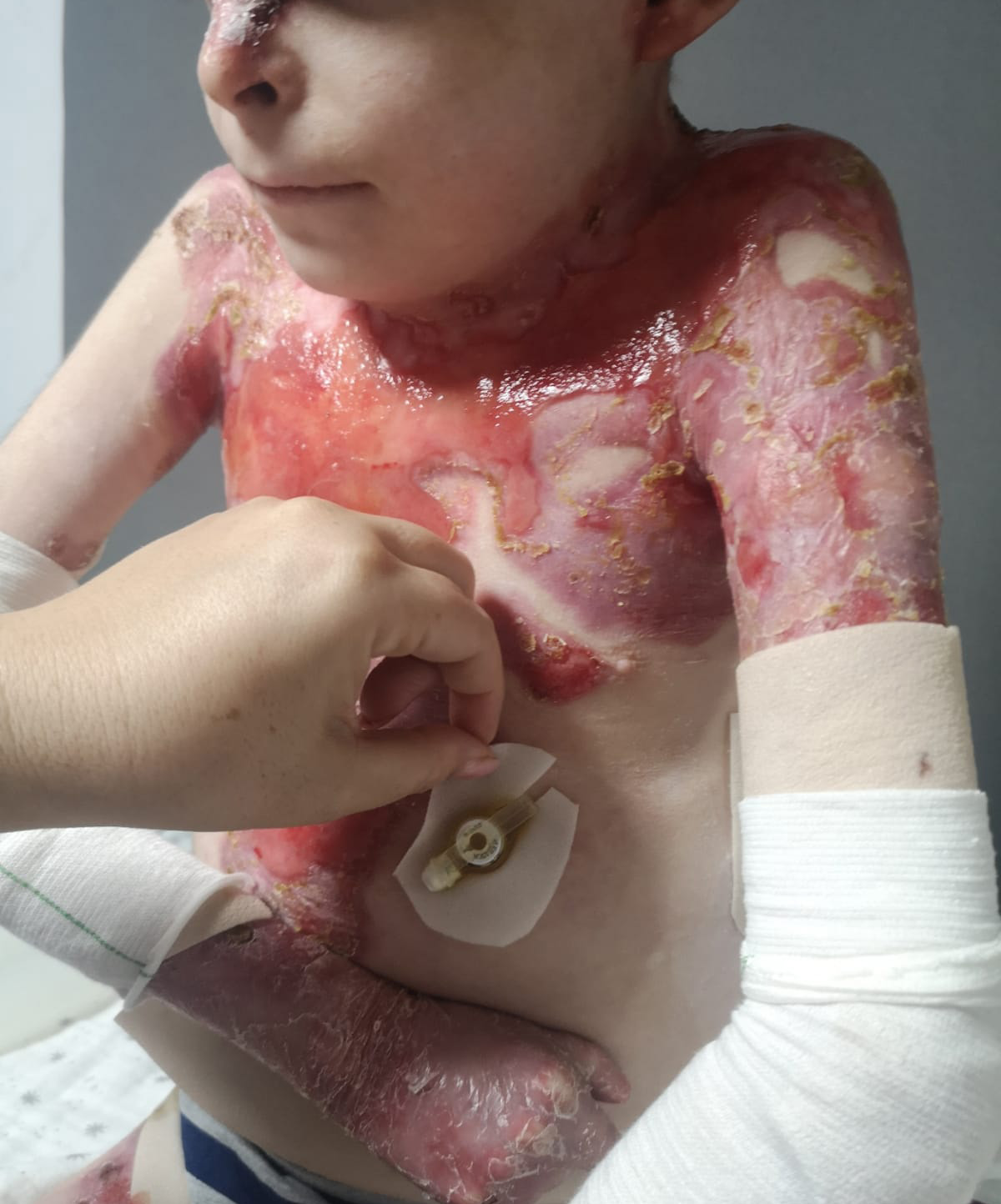
“La esperanza es lo último que se pierde, y eso es lo que nos impulsa a seguir luchando con mucha positividad. Porque creemos que vamos a conocer la cura. Pero necesitamos que se agilicen todos los trámites lo máximo posible, para que todas las personas con Piel de Mariposa distrófica puedan disfrutar de sus efectos cuanto antes”, comenta Lidia Osorio, la madre de Leo.